医药制造业政策法规环境有哪些最新变化?
核心概述
中国医药制造业的政策法规环境可以概括为:“以人民健康为中心,以创新为驱动,以质量为基石,以监管为保障”,政策导向非常明确,即推动行业从“仿制药大国”向“创新药强国”转型,同时确保药品的“安全、有效、可及、质量可控”。
这个环境具有以下鲜明特点:
- 高监管、强合规:药品是特殊商品,监管贯穿从研发到上市后监测的全生命周期。
- 政策密集、迭代迅速:为了应对行业发展和满足公众需求,政策出台频繁,且不断调整优化。
- 鼓励创新、淘汰落后:通过优先审评、专利保护、医保谈判等组合拳,鼓励企业投入研发,同时淘汰不合规、低产能的落后企业。
- 全链条、一体化管理:监管范围覆盖研发(CRO)、生产(CMO/CDMO)、流通(医药分销)、零售(药店)等整个产业链。
核心监管机构
理解政策法规,首先要了解监管体系,中国的医药监管主要由以下机构负责:
- 国家药品监督管理局:核心监管机构,负责药品、医疗器械、化妆品的审批、注册、生产质量管理、上市后监管等,其下设的药品审评中心、核查中心、审核查验中心等是具体执行部门。
- 国家卫生健康委员会:负责医疗卫生服务体系的建设、管理,以及医保目录的制定和调整(与国家医保局协同)。
- 国家医疗保障局:负责基本医疗保险、生育保险和医疗救助等,其最重要的职能之一是组织药品集中带量采购(“集采”)和医保目录谈判,直接决定药品的市场准入和价格。
- 国家发展和改革委员会:负责药品价格的宏观调控,以及重大项目审批。
- 国家中医药管理局:负责中医药政策法规的制定和行业管理。
主要政策法规领域及分析
以下是医药制造业面临的关键政策领域及其影响:
研发与创新
这是政策鼓励的重点,旨在提升中国医药的自主创新能力。
- 《药品注册管理办法》:建立了“默示许可”制度,即临床试验默示许可(默示同意)、上市许可默示许可和药品生产许可默示许可,这大大缩短了新药的临床试验审批时间,鼓励了创新。
- 优先审评审批:针对具有明显临床价值的创新药、短缺药等,开辟“绿色通道”,加快审评审批速度。
- 专利链接与专利补偿制度:这是中国知识产权保护的重大进步,新药专利与仿制药申请链接,可以及早解决专利纠纷;为创新药提供专利期补偿,弥补因行政审批占用的时间,保护创新者的利益。
- 鼓励真实世界数据应用:支持利用真实世界证据来支持药品的审批和适应症拓展,为创新药提供了更多循证医学支持。
- 鼓励临床研究和转化:政策鼓励开展多中心临床试验,并支持医疗机构和科研院所的成果转化。
影响:利好头部创新药企和Biotech公司,研发管线丰富、拥有核心专利的企业将获得巨大发展机遇,企业必须从“Me-too”向“First-in-class”或“Best-in-class”转型。
生产与质量
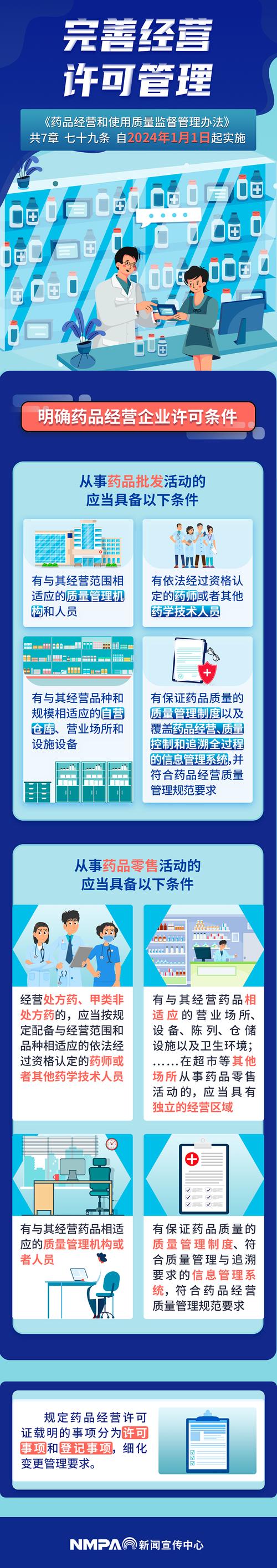
确保药品质量是监管的基石,近年来要求越来越严。
- 《药品生产质量管理规范》:这是药品生产的“宪法”,要求企业建立全面的质量管理体系,近年来,监管部门对GMP的现场检查(飞检)愈发频繁和严格,不合规企业将面临停产、罚款甚至吊销执照的风险。
- 一致性评价:要求仿制药必须与原研药在质量和疗效上达到一致,这是仿制药准入和参与集采的“入场券”,未通过评价的仿制药将逐步被市场淘汰。
- 原料药、辅料与包材关联审评审批:将上游物料纳入监管,确保源头质量。
- 环保与安全生产:化工园区整治、环保要求趋严,对原料药企业的生产和成本构成压力,但也推动了行业绿色、可持续发展。
影响:加速行业出清和集中度提升,中小型、质量管理体系不完善的企业生存空间被严重挤压,拥有高质量生产能力和通过一致性评价的仿制药企业更具竞争力。
采购与支付
这是决定药品“市场准入”和“价格”的最关键环节,深刻影响着企业的收入和利润。
- 国家组织药品集中带量采购(“集采”):
- 模式:政府组织,以省或联盟为单位,明确采购量,企业以价换量,通过竞价确定中标价格。
- 范围:从最初的“4+7”试点,已扩展到多批多类,覆盖化学药、生物药、中成药、高值医用耗材等。
- 影响:
- 对仿制药:价格大幅下降(平均降幅50%以上),但通过“以量换价”保证了稳定的市场份额,未中标企业面临巨大生存危机。
- 对创新药:短期内影响较小,因为创新药通常不参与集采,但创新药最终会面临医保谈判的压力。
- 国家基本医疗保险、工伤保险和生育保险药品目录调整(“医保谈判”):
- 模式:将临床价值高、价格昂贵的创新药、独家药品纳入医保目录,国家医保局与企业进行价格谈判,以换取更大的市场准入和报销范围。
- 影响:
- 对创新药企:是“生命线”,进入医保目录意味着药品可及性大幅提升,销量激增,但需要大幅降价(平均降幅50%-60%),这是一场“价量交换”的博弈。
- 对未进医保的创新药:市场推广难度极大,主要依赖自费市场。
影响:重塑行业商业逻辑,企业不能再依赖高定价、低销售的旧模式,必须构建“成本可控、临床价值突出”的研发管线,并善于与医保局进行价值沟通。
流通与零售
旨在减少流通环节,降低成本,保障药品供应。
- “两票制”:要求药品从生产企业到流通企业,再到医疗机构,最多只能开两次发票,这压缩了流通环节的层层加价,规范了市场秩序,但也加速了中小型医药商业公司的淘汰。
- 零售药店分类分级管理:鼓励连锁化、专业化发展,支持药店承接门诊统筹、慢病管理等医疗服务,成为医疗健康服务的重要入口。
- 互联网+医疗健康:支持在线问诊、电子处方、网售处方药等,为药品零售提供了新的渠道。
影响:行业集中度提升,大型医药流通企业和连锁药店受益,小型、分散的流通企业和单体药店生存压力增大。
知识产权与国际化
- 专利保护:如前所述,专利链接和补偿制度加强了对创新成果的保护。
- 鼓励国际化:
- “走出去”:鼓励中国药企开展国际多中心临床试验,申请欧美等发达国家的药品上市许可,提升国际竞争力。
- “引进来”:鼓励引进国际先进技术和产品,但通过集采和医保谈判控制其价格。
影响:推动中国医药企业参与全球竞争,有实力的企业开始布局全球市场,而不仅仅是国内市场。
未来趋势与展望
- 持续创新是核心:政策将继续向源头创新倾斜,鼓励细胞和基因治疗、mRNA等前沿技术领域。
- 全生命周期监管:从研发到上市后监测(如药物警戒)的监管将更加精细化、智能化,利用大数据等技术提升监管效能。
- 支付方式改革深化:DRG/DIP(按病种分值付费)等支付方式改革将全面推开,倒逼医院和医生合理用药,影响药品的临床使用。
- 中医药现代化与国际化:政策将继续支持中医药的传承、创新和标准化,推动中医药走向世界。
- 产业链安全自主可控:在关键原料药、辅料、核心生产设备等领域,将更加重视供应链的稳定和安全。
中国的医药制造业政策法规环境是一个“组合拳”,它通过“胡萝卜加大棒”的方式,强力引导行业转型。
- “胡萝卜”:优先审评、专利保护、医保准入等,激励企业投入创新。
- “大棒”:集采、一致性评价、飞检等,淘汰落后产能,压缩低水平竞争。
对于医药企业而言,必须深刻理解并适应这一环境,未来的赢家,必然是那些能够“以临床价值为导向,以持续创新为引擎,以合规经营为底线”的企业,单纯依靠营销或仿制套利的企业将难以为继。
作者:99ANYc3cd6本文地址:https://bj-citytv.com/post/1210.html发布于 2025-12-14
文章转载或复制请以超链接形式并注明出处北京城市TV