中国药品注册最新政策
中国的药品监管政策近年来经历了“翻天覆地”的改革,其核心目标是鼓励创新、提高审评审批效率、保证药品安全有效、可及,这些改革深刻地影响着国内外药企的研发和上市策略。
(图片来源网络,侵删)
以下我将从几个核心维度,为您解读最新的政策要点和趋势:
核心指导思想与顶层设计
中国药品监管的改革是在“以人民为中心”和“四个最严”(最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责)的总体要求下推进的。
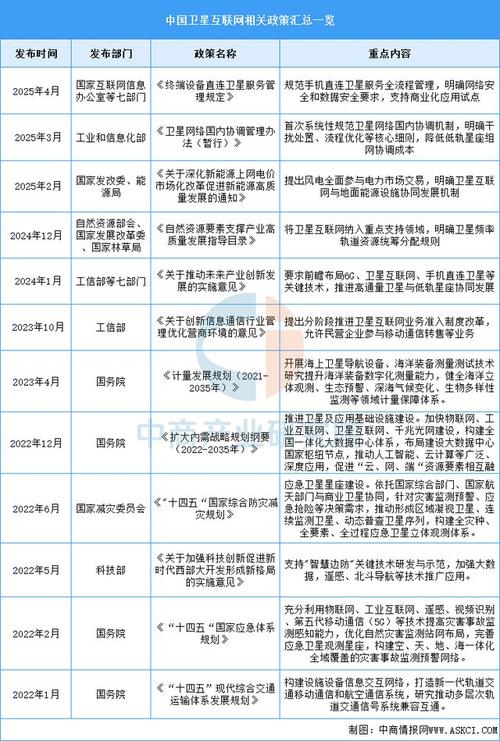
- 《中华人民共和国药品管理法》(2025年修订):这是药品监管领域的根本大法,确立了药品上市许可持有人制度,强化了全过程监管,并引入了药品专利链接和专利补偿等鼓励创新的制度。
- 《中华人民共和国疫苗管理法》(2025年):作为史上最严的专门法律,对疫苗实行了最严格的监管,体现了国家对特殊药品安全的高度重视。
- 《药品注册管理办法》(2025年):与药品管理法配套,详细规定了药品注册的申请、受理、审评、审批、核查和检验等全流程。
最新核心政策与趋势解读
鼓励创新:从“跟跑”到“并跑”甚至“领跑”
这是当前中国药品注册政策最鲜明的导向,国家通过多种方式,为真正的创新药“开绿灯”。
-
优先审评审批:
(图片来源网络,侵删)- 适用范围:针对具有明显临床价值的创新药、短缺药、儿童用药等。
- 最新趋势:范围不断扩大,审评审批时限大幅缩短,符合要求的创新药临床试验申请(IND)和上市许可申请均可进入优先审评通道,NDA(新药上市申请)的审评时限从过去的6-10个月缩短至120个工作日左右。
-
突破性治疗药物程序:
- 定位:这是比“优先审评”更早介入的通道,用于认定临床优势明显的创新药,可以在临床试验早期就获得与CDE(国家药品监督管理局药品审评中心)的深度沟通交流,从而更高效地设计后续临床试验。
- 意义:体现了监管的前瞻性和灵活性,旨在解决“卡脖子”的临床需求。
-
附条件批准:
- 适用场景:用于治疗严重危及生命且尚无有效治疗手段的疾病,或临床优势明显但存在研究数据暂时不完整等情况的创新药。
- 操作方式:在确证其临床价值的前提下,有条件地批准上市,要求药企在上市后继续完成确证性研究。
- 作用:极大地加速了重大疾病领域(如肿瘤、罕见病)新药的可及性。
-
加速批准:
- 核心:基于替代终点(如肿瘤的ORR、PFS等)或临床结局替代终点的有力证据来批准药品上市。
- 前提:该替代终点必须经过验证,能够预测临床获益。
- 目的:让患者能更快用上新药,同时要求上市后继续验证其临床获益。
-
专利链接与专利补偿制度:
(图片来源网络,侵删)- 专利链接:原研药的专利信息会登记在官方数据库中,仿制药申报时,需声明是否涉及相关专利,如果专利权人发起专利挑战,仿制药的上市审批会暂时中止。
- 专利补偿:为弥补因行政审批延迟导致的有效期损失,国家可以对符合条件的创新药专利期给予适当延长(最长不超过5年)。
- 意义:这是中美贸易协定的重要组成部分,旨在保护创新,同时也为仿制药的“首仿”提供了市场独占期激励,平衡了创新与仿制。
提高审评效率与国际接轨
-
接受境外临床试验数据:
- 政策:在符合特定条件下,可以接受境外多中心临床试验数据作为药品在中国注册的申报依据。
- 要求:需要证明中国患者与境外患者在人群特征、疾病分期、治疗方案等方面具有相似性,确保数据在中国人群中的适用性。
- 影响:大大加速了国际创新药进入中国市场的进程,使中国的药品审评体系更加国际化。
-
接受境外生产场地检查:
- 政策:允许CDE在与其他国家/地区药品监管机构达成互认协议或合作框架的基础上,接受其境外生产现场的检查结果。
- 影响:简化了跨国药企在华申报的流程,降低了企业成本。
-
生物类似药路径:
- 政策:为生物类似药设立了专门的审评审批路径,要求其与原研药(参照药)在质量、安全性和有效性(相似性)方面达到高度一致。
- 意义:在鼓励生物创新的同时,也为生物类似药提供了清晰的上市路径,有助于降低医疗成本,提高药品可及性。
加强全生命周期监管:上市后监管与MAH制度
-
药品上市许可持有人制度:
- 核心:将药品的“所有权”和“责任主体”分离,药品研发机构、生产企业等都可以成为MAH,对药品的非临床研究、临床试验、生产经营、上市后研究、不良反应监测及报告等承担主体责任。
- 影响:极大地激发了研发机构的积极性,促进了科研成果的转化,也明确了药品安全的最终责任人。
-
药品生产场地变更技术指导原则:
- 要求:MAH变更药品生产场地(包括新建、迁建等)必须进行充分的研究和验证,并向监管部门申报,确保变更后的产品质量与原场地一致。
- 趋势:监管趋严,对变更研究和验证的要求越来越高,旨在防止“带病生产”和转移生产过程中的风险。
-
药品说明书和标签的动态管理:
- 要求:MAH需要根据最新的安全性信息、临床研究数据等,主动申请更新药品说明书和标签。
- 趋势:监管部门会定期发布要求修订说明书的公告,强制企业更新,以确保医生和患者能获得最新的安全用药信息。
对企业的影响与建议
- 战略上,坚定创新导向:企业应将资源投入到具有真正临床价值的创新药研发上,积极利用“突破性治疗”、“附条件批准”等政策红利,加速产品上市。
- 研发上,尽早与CDE沟通:在临床试验设计、关键选择等关键节点,尽早通过“Pre-IND会议”、“End-of-Phase 2会议”等机制与CDE进行科学、高效的沟通,确保研发方向的正确性。
- 国际化上,做好全球同步开发:对于有潜力的创新药,应考虑中美欧等多国同步申报策略,利用“接受境外临床数据”等政策,实现全球范围内的快速上市。
- 质量上,全生命周期管理:建立完善的质量管理体系,从研发到生产再到上市后监测,都要以最高标准要求自己,MAH制度的落实,要求企业必须对药品的整个生命周期负总责。
- 合规上,严守法律红线:随着监管的趋严,任何在临床试验数据、生产过程、药品申报等方面的不合规行为都将面临严厉处罚,企业必须建立强大的合规体系。
中国药品注册政策已经形成了一套“鼓励创新、加快审评、强化监管、国际合作”的完整体系,其核心逻辑是:用最快的速度让最好的创新药到达最需要的患者手中,同时用最严格的监管确保药品的安全有效。
对于国内外药企而言,这意味着挑战与机遇并存,深刻理解并适应这些政策变化,将是未来在中国市场取得成功的关键,建议企业密切关注国家药品监督管理局和药品审评中心的官方网站,获取第一手的法规文件和指导原则。
文章版权及转载声明
作者:99ANYc3cd6本文地址:https://bj-citytv.com/post/4729.html发布于 01-21
文章转载或复制请以超链接形式并注明出处北京城市TV